基因与细胞治疗领域核心法律制度及前沿实务法律问题系列研究(上)
2021-11-10
前言
本轮“三医”改革是在高质量发展的大背景下,融合国家机构改革和外商投资监管、数据安全和信息保护、人类遗传资源管理、专利链接管理等制度建立与完善过程的系统性改革。期间我国立法机构在上述领域制定或修订大量的基础性法律法规。同时,在深化药审改革、医保改革、医疗服务改革方面,通过完善相关法律法规落实了加快审评审批、产注分立、境外试验数据接受、真实世界研究、医保目录调整与集采常态化、分级诊疗体系、互联网医疗、合理用药等制度。截止目前我国“三医”涉及的多领域、多部门协同的法律法规体系已经相对成熟。
随着2021年6月CAR-T产品奕凯达被国家药监局获批上市,我国细胞与基因治疗(以下简称:CGT)正式进入临床应用的商业化阶段。作为生物制剂药品,CGT药品当然地受我国现行药品管理相关法规监管。目前CGT的治疗机制、基因治疗载体安全性、临床试验安全性等问题尚待进一步积累和完善,我国针对CGT药品的生产标准和规范仍在持续调整和完善中, 行业具体的监管和法规政策跟我国现有医药领域法律体系存在一个融合和适用过程,给我国CGT行业的合规和稳健发展带来了一定的不确定性。
本系列研究分上、中、下三篇,通过分析细胞与基因治疗产业涉及的核心法律制度和前沿法律问题,旨在为细胞与基因治疗产业的合规和稳健发展探索系统性解决方案和思路。本文将对CGT行业涉及的核心法律制度进行综述,并讨论外商投资监管、人类遗传资源管理等问题。
一、我国生物制药监管体系及CGT行业涉及的核心法律制度综述
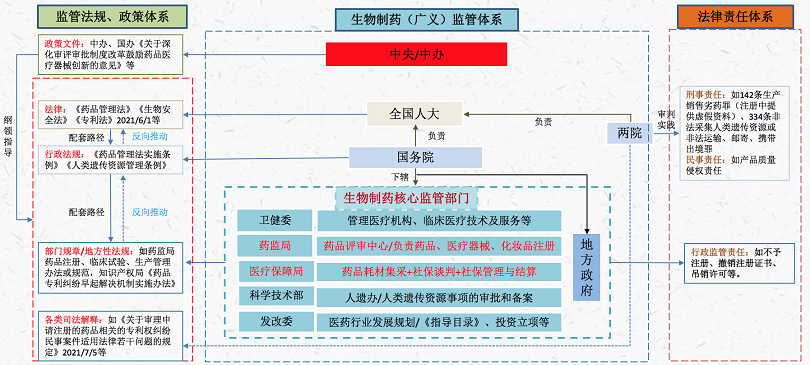
(一)我国生物制药监管体系
细胞及基因治疗药物属生物制药,当然地按照我国药品管理相关法律法规监管。目前我国生物制药的监管体系如下:
(二)CGT药品的范畴及法律界定
关于细胞治疗,原食药监局于2017年发布的《细胞治疗产品研究与评价技术指导原则(试行)》中提出“细胞治疗药品是指用于治疗人的疾病,来源、操作和临床试验过程符合伦理要求,按照药品管理相关法规进行研发和注册申报的人体来源的活细胞产品”,一般不包括“输血用的血液成分,已有规定的、未经体外处理的造血干细胞移植,生殖相关细胞,以及由细胞组成的组织、器官类产品等”。
目前细胞治疗领域以免疫细胞治疗最有代表性。国家药监局药物评审中心(以下简称:CDE)2021年2月发布的《免疫细胞治疗产品临床试验技术指导原则(试行)》中明确,免疫细胞治疗“是利用患者自身或供者来源的免疫细胞,经过体外培养扩增、活化或基因修饰、基因编辑等操作,再回输到患者体内,激发或增强机体的免疫功能,从而达到控制疾病的治疗方法”。根据作用机制的不同,目前的细胞免疫治疗研究类型主要包括:肿瘤浸润淋巴细胞(TILs)、嵌合抗原受体T细胞(CAR-T)以及工程化T细胞受体修饰的T细胞(TCR-T)等,此外还存在基于自然杀伤细胞(NK)或树突状细胞(DC)等其它免疫细胞的治疗方法。
针对基因治疗(目前仅限于体细胞),根据2020年9月CDE发布的《基因治疗产品药学研究与评价技术指导原则(征求意见稿)》的规定,基因治疗产品是在人体细胞内,利用“细胞工厂”进一步表达产物或编辑细胞基因发挥功能的“活”的产品,“通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为 DNA、RNA、基因改造的病毒、细菌或细胞等”。广义上的基因治疗包括经过或未经基因修饰的、具有特定功能的溶瘤病毒产品。根据基因载体类型的特性差异,基因治疗产品主要可分为以病毒为载体的基因治疗产品、以质粒 DNA 为载体的基因治疗产品、RNA类基因治疗产品,以及以细菌微生物为载体的基因治疗产品,其中以病毒和质粒 DNA 为载体的基因治疗产品较为常见。按基因导入的形式,分为体外基因导入 (exvivo)及体内基因导入(invivo)两种形式。
目前已上市和临床试验阶段的细胞和基因治疗药品主要靶向肿瘤、罕见遗传性疾病等适应症。从治疗的技术路径角度,目前业界普遍认为细胞治疗与基因治疗的关系如下:

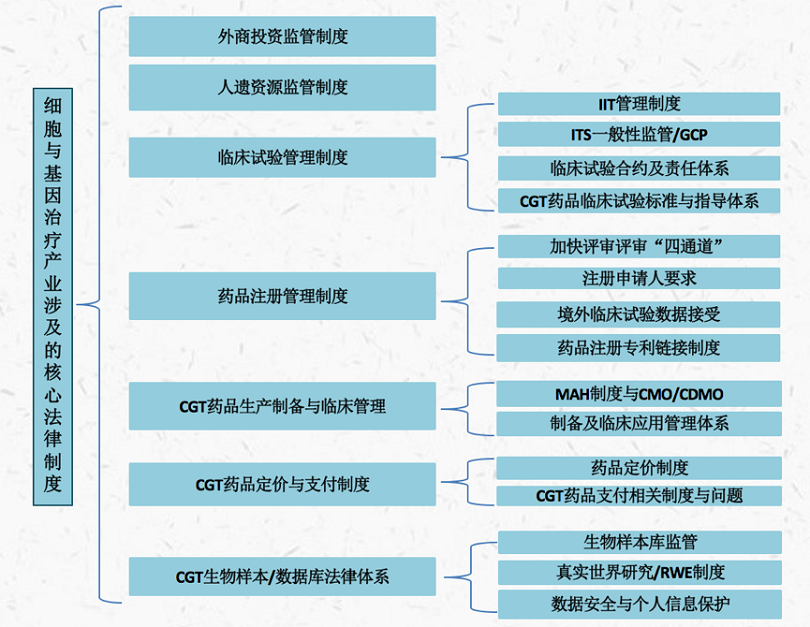
(三)我国CGT产业涉及的核心法律制度及法律问题综述
结合当前行业实践,我们认为我国CGT产品涉及的核心法律制度如下图:
二、CGT行业涉及的外商投资管理问题
商务部、发改委联合发布的《外商投资准入特别管理措施(负面清单)》(2020年版)在“科学研究及技术服务业”部分明确了“禁止投资人体干细胞、基因诊断与治疗技术开发和应用”;《鼓励外商投资产业目录》(2020版)在“医药制造业”部分明确了鼓励外商投资“细胞治疗药物研发与生产(禁止外商投资领域除外)”和“疫苗、细胞治疗药物等生产用新型关键原材料、大规模细胞培养产品的开发、生产”。
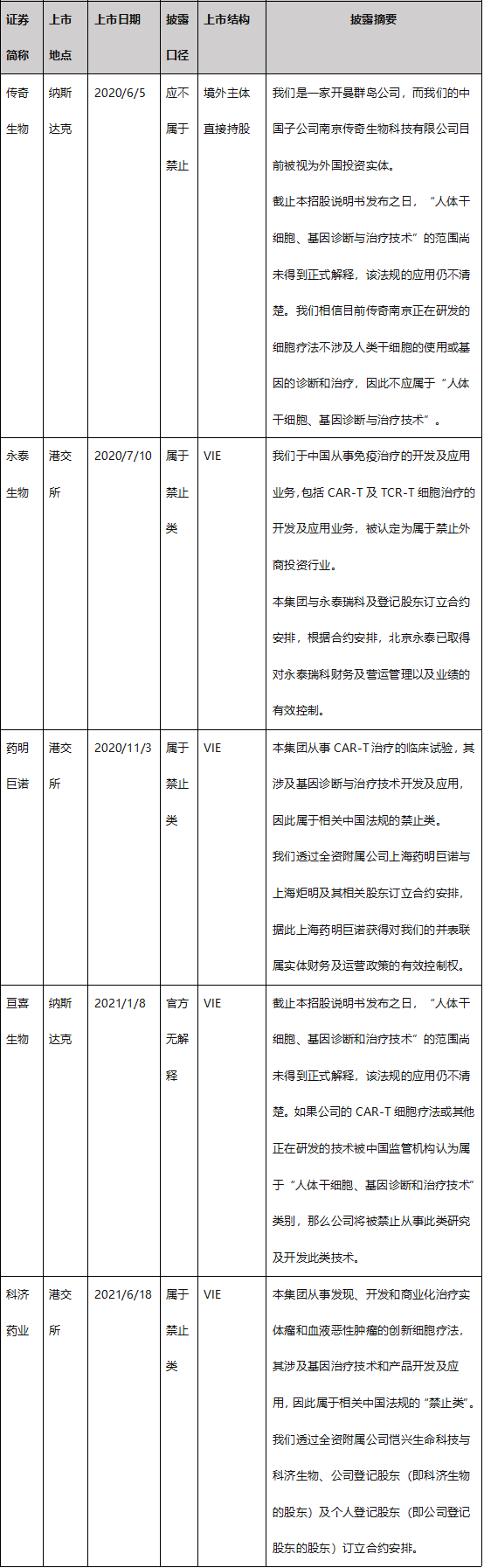
业界对于干细胞、基因诊断与治疗的外商禁止基本不存在分歧。由于主管机构目前对“人体干细胞、基因诊断和治疗技术”和“细胞治疗药物研发与生产”中例外情形的具体范围尚未出台明确的解释,在产业实践中,呈现认识和执行口径不一的业态。以CAR-T细胞治疗领域为例,基于对法规适用的谨慎考量,多数行业公司在上市时选择了VIE结构。目前已上市的CAR-T细胞治疗领域企业在外商投资问题上的披露口径如下:
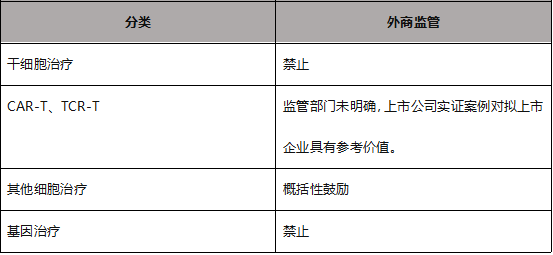
鉴于上文细胞与基因治疗的分类,我们认为,针对CGT行业的外商投资监管如下:
三、CGT行业涉及的人类遗传资源管理问题
CGT产品因其“活产品”的属性,且从技术路径上必然涉及基因组学、细胞组学等多组学和临床治疗的样本和数据,在早期探索性研究、注册研究(含以上市为目的的1期、2期和3期研究)、上市后研究(如真实世界的适应症拓展研究)、生物样本和数据的存储与使用、外部科研合作、CXO、跨国多中心数据传输、论文及专著发表等环节均涉及人类遗传资源审批或备案管理问题。
(一)人类遗传资源类别及整体管理要求
1. 人类遗传资源的具体类别和内容
《人类遗传资源管理条例》(以下简称:人遗条例)第二条规定,人类遗传资源包括人类遗传资源材料和人类遗传资源信息。
人类遗传资源材料是指含有人体基因组、基因等遗传物质的器官、组织、细胞等遗传材料,在实践中通常包括指全血、血清、血浆、尿液、粪便、血细胞、脑脊液、骨髓、骨髓涂片、血涂片、组织切片、其他样本等。
人类遗传资源信息是指利用人类遗传资源材料产生的数据等信息资料。在实践中主要包括以下数据:(1)临床数据,如人口学信息、一般实验室检查信息等;(2)影像数据,如 B 超、CT、PET-CT、核磁共振、X 射线等;(3)生物标志物数据, 如诊断性生物标志物、监测性生物标志物、药效学/反应生物标志物、预测性生物标志物、预后生物标志物、安全性生物标志物、易感性/风险生物标志物;(4)基因数据,如全基因组测序、外显子组测序、目标区域测序、人线粒体测序、全基因组甲基化测序、lnc RNA 测序、转录组测序、单细胞转录组测 序、small RNA 测序等;(5)蛋白质数据;(6)代谢数据等。
2. 我国对人类遗传资源的整体管理要求
我国对人类遗传资源实施严格的审批和备案管理,对外方单位使用我国人遗资源的监管。《生物安全法》第56条明确了“境外组织、个人及其设立或者实际控制的机构不得在我国境内采集、保藏我国人类遗传资源,不得向境外提供我国人类遗传资源。人遗条例第7条也规定,“外国组织及外国组织、个人设立或者实际控制的机构(以下称外方单位)需要利用我国人类遗传资源开展科学研究活动的,应当遵守我国法律、行政法规和国家有关规定,并采取与我国科研机构、高等学校、医疗机构、企业合作的方式进行。”
在监管实践中,科技部依法开展采集审批、保藏审批、国际合作科学研究审批、出境审批的行政许可,和对外提供和开放我国人类遗传信息的备案工作。其中采集审批适用于在中国境内从事的中国人类遗传资源采集活动,包括重要遗传家系、特定地区人类遗传资源和科技部规定种类、数量的人类遗传资源的采集活动的规范和管理;保藏审批适用于对在中国境内从事中国人类遗传资源保藏活动、为科学研究提供基础平台的事项的规范和管理;国际合作科学研究审批适用于对利用中国人类遗传资源开展国际合作科学研究的规范和管理;出境审批适用于对利用中国人类遗传资源开展国际合作科学研究,或者因其他特殊情况确需将中国人类遗传资源材料运送、邮寄、携带出境的规范和管理。
同时人遗条例第3条规定,”为临床诊疗、采供血服务、查处违法犯罪、兴奋剂检测和殡葬等活动需要,采集、保藏器官、组织、细胞等人体物质及开展相关活动,依照相关法律、行政法规规定执行”。如在医疗实践中,医院常规所做的临床诊疗项目检测,将具有人类遗传资源信息的样本外送至第三方检验室(含具有外资背景),多未向国家人类遗传资源办公室进行审批或备案。
(二)我国人类遗传管理各审批和备案事项具体监管要点
1. 采集监管要点
根据人遗条例和科技部相关配套文件,人遗资源采集监管核心要素如下:

目前我国采集审批主要由国内医院或疾控中心申请。结合业界实践,我们人针对人类遗传资源采集问题,应重点关注以下问题:
(1)在采集数量的统计
科技部规定需履行采集审批的数量阈值为“累计500例”,在计量时应包含所有筛选数而非仅限实际入组数,即病例数包含筛选失败病例。
(2)“外方单位的采集禁止+鼓励国际合作”相结合促进中国疾病谱、罕见病攻克
人遗条例第11条规定的遗传家系,一般是指患有遗传性疾病或具有遗传性特殊体质或生理特征的有血缘关系的群体,如遗传性耳聋基因突变及其他单基因遗传性疾病,遗传性家系中的疾病多属罕见病;特定区域人类遗传资源,一般是指隔离或特定环境长期生活并具有特殊体质特征或在生理特征方面有适应性性状发生的人群遗传资源,如鼻咽癌、苯丙酮尿症等,这部分疾病本身属于中国人群疾病谱。
在我国加强人类遗传资源管理、禁止外方单位采集、保藏我国人类遗传资源的同时,又通过医药注册改革,确定境外临床试验数据接受、MAH制度等与国际接轨,加大境外已上市药品在境内的上市或仿制,以解决我国患者对临床迫切需求领域药品的可及性。而衔接二者的主要机制之一即是人遗条例19条确定的“国家鼓励科研机构、高等学校、医疗机构、企业根据自身条件和相关研究开发活动需要,利用我国人类遗传资源开展国际合作科学研究,提升相关研究开发能力和水平”的鼓励国际合作机制。详见本章“国际合作审批和备案监管要点”部分。
2. 保藏监管要点及监管实践分析
根据人遗条例和科技部相关配套文件,人遗资源保藏监管核心要素如下:

(1)保藏审批及申请主体的类别
以2021年保藏许可审批实践为例,获得保藏许可的主体以医院为主,同时还包含科研机构(如广东省肾脏病研究所)、高等学校(如北京大学、西藏大学)和部分企业(如南京艾尔普再生医学科技有限公司)。
从保藏审批依托项目类型看,主要包括医院临床数据和样本库项目、医院/科研院所/企业的生物样本库项目、国家医学中心等组学或健康数据库三类。各类别代表项目示例如下:
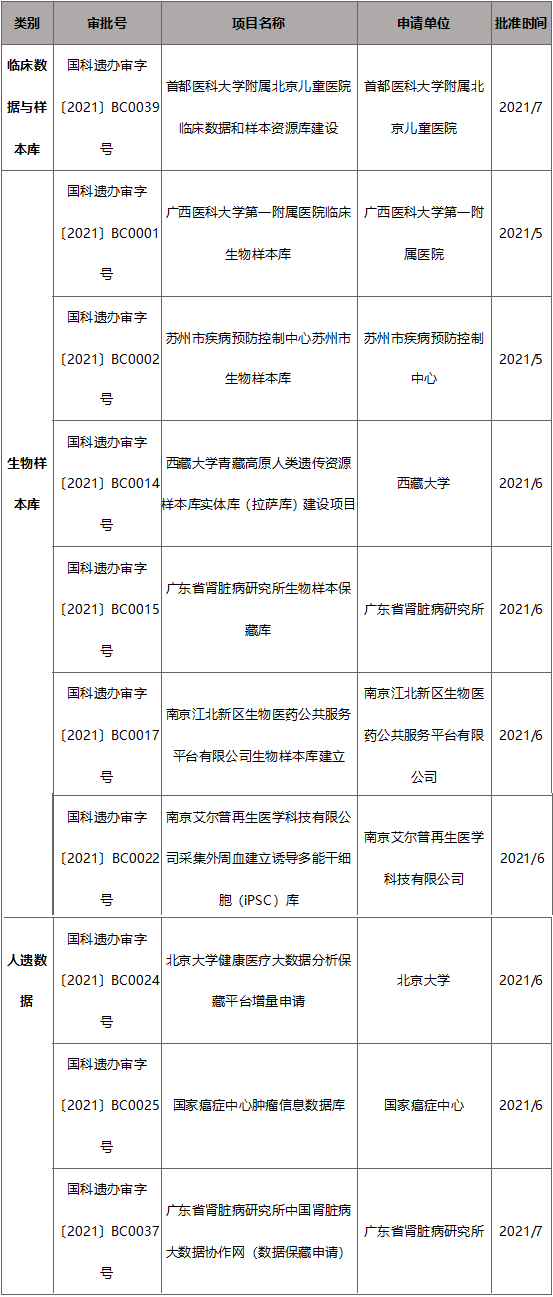
(2)实践中各类“细胞中心”、“基因数据中心”的监管口径评析
按照生物样本库相关规范和标准的内涵,生物样本库包含国家级、省级大型生物样本库,区域生物样本库、医疗机构和高校、企业生物样本库、实验室的小型生物样本库以及储存和制备细胞和组织储存库等。
在实践中,存储人类遗传资源的主体除医院、科研院所、高校经依法履行伦理审批、保藏许可等建立的生物样本库外,很多CGT药品研发企业、独立检测实验室、三方保藏单位由于自身业务需要,也涉及细胞、组织、基因检测数据等生物样本和数据的存储,且对外以“细胞中心”、“基因数据中心”名义开展CRO等合作。
《中国人类遗传资源保藏审批行政许可事项服务指南》中明确,“保藏”是指将来源合法的人类遗传资源保存在适宜环境条件下,保证其质量和安全,用于未来科学研究的行为,不包括实验室检测后按照法律、法规要求或临床研究方案约定的临时存储行为。人遗条例第3条也明确了“为临床诊疗需要”不适用人遗资源采集、保藏的审批监管。上述规定也成为相关CGT企业未按照人类生物样本库监管口径履行相关的伦理和人遗审批程序所依托的法律支点,即上述主体认为其对生物样本和数据的存储属于“实验室检测后按照法律、法规要求或临床研究方案约定的临时存储行为”或基于“临床诊疗需要”。
综上,我们认为,对于CGT企业而言,应当注意在临床试验方案设计中设定科学的样本或数据存储时间,在临床试验或检测的知情同意环节,向受试者充分提示并取得其书面同意,并随时关注人遗办对于突破“临床诊疗”范畴,且将“临时存储”的人类遗传资源材料或信息用于对外CRO或科研合作的监管口径变化,适时并入生物样本库监管口径履行伦理审批、保藏许可等程序。
3. 国际合作审批与备案监管要点
根据人遗条例和科技部相关配套文件,人遗资源国际合作管理的核心要素如下:
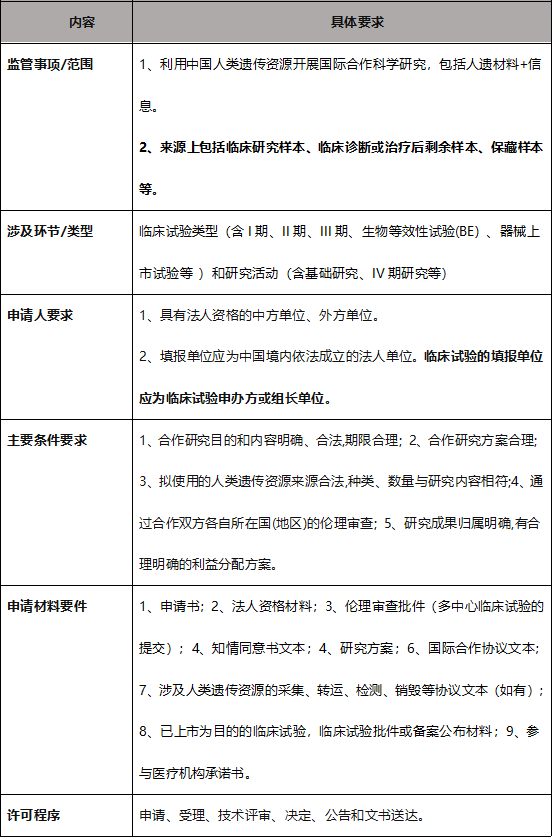
(1)合作方的范围
合作方是指参与合作的所有中方单位、外方单位。为获得相关药品和医疗器械在我国上市许可的临床试验合作方包括临床试验申办方、医疗机构(组长单位)、合同研究组织、第三方实验室等。即任何一方为外方单位均应申请国际合作审批。
(2)“外方单位”的认定
首先,港澳台组织及港澳台组织、个人设立或者实际控制的机构,跨国药企,以及按照新《外商投资法》注册为外商投资企业的境内企业,均有作为外方机构进行人遗监管的实践案例。
其次,从当前的监管实践看,尽管在VIE结构中,外商独资企业(WOFE公司)通过合约安排取得对VIE主体财务及营运管理以及业绩的有效控制,但针对在港股、美股的上市公司在境内的VIE主体,人遗监管系按照境内机构执行。对此,科济药业在其招股文件中进行披露和风险提示,“鉴于HGR条例缺乏明确的法律解释,倘若我们的VIE实体被相关政府主管部门认定为受限实体,我们的业务将受到不利影响,我们可能需要就目前的业务向相关政府主管部门获得批准”,“及/或与非HGR条例中受限实体的国内实体合作,并需要就该合作获得相关政府主管部门的批准或备案”。我们认为,在我国法律法规对VIE结构和制度的整体法律效果评价调整或变更之前,VIE主体当不属于外方单位。
(3)国际合作的备案问题
为获得相关药品和医疗器械在我国上市许可,在临床机构利用我国人类遗传资源开展国际合作临床试验、不涉及人类遗传资源材料出境的,由中国境内依法成立的法人单位办理备案。需注意,若由申办方委托中心实验室的,因不属于“所涉及的人类遗传资源在临床机构内采集,由临床机构委托的单位进行检测、分析和剩余样本处理等,临床机构应与其委托的单位签署正式协议”的规定,应按国际合作科学研究审批申报,或者报送由临床机构与其委托单位签署的正式协议后按按照国际合作备案程序申报。
4. 人遗资源材料出境监管要点
根据人遗条例和科技部相关配套文件,人遗资源材料出境监管的核心要素如下:
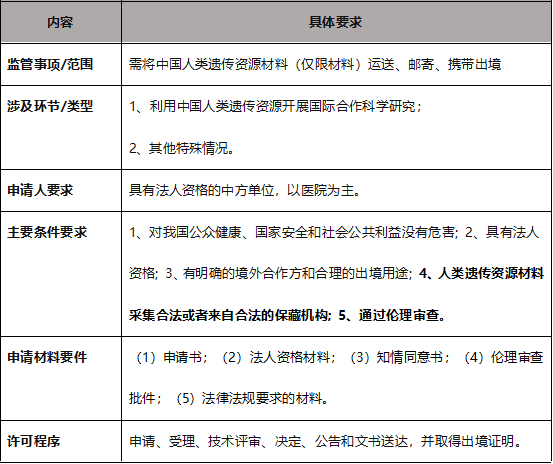
CGT行业许多环节均涉及海关出入境问题,如单抗培养基、病毒毒株、检测试剂、相关设备等。可以预见,随着国家生物安全管理力度和措施的不断加强,我国人类遗传资源材料的出境管理力度将进一步加大。
5. 人遗资源信息对外提供或开放监管要点
根据人遗条例和科技部相关配套文件,人遗资源信息对外提供和开放使用的监管的核心要素如下:
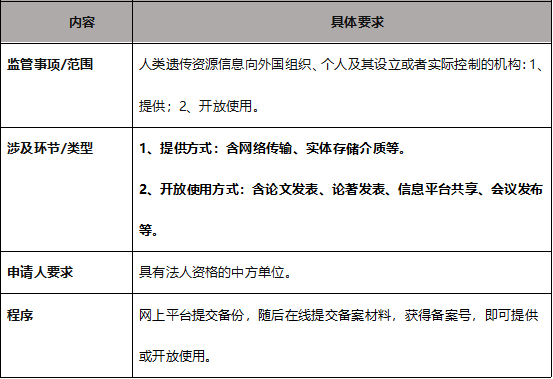
针对人遗信息的对外提供和开放使用的备案备份,应关注一下问题:
(1)需要备案备份情形包括多种形式
比如国外发表文章、国外会议公开、信息平台共享,EDC系统为外资供应商,数据管理服务方为国外CRO等。
(2)事前备份备案机制与CGT产业发展的兼容
当前“需要做备份备案的数据范围”并无明确的定义,理论上向境外供应商或提供任何数据之前,均需向人遗办进行信息数据备份和备案。对于CGT药品的研发和制备增加了一定的时间成本,尤其是全球多中心临床研究项目中,原将实验样本和数据统一运输到一个全球中央实验室和数据供应商,以最大程度地平衡样本和数据分析的效率与质量的模式将受到一定的挑战。
业界也普遍期待监管部门后续的配套政策能形成在有效保护我国人类遗传资源的前提下,鼓励中国创新药研发的机制。
本文作者:
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。