类器官临床与商业化应用监管业态趋势探析及应对建议
2021-12-09
前言
2021年12月3日,CDE发布《基因治疗产品非临床研究与评价技术指导原则(试行)》、《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》,在“动物模型”、“动物种属/模型选择”部分,均提到在没有合适的动物模型时,类器官可作为替代性模型进行替代模型试验,为相关研究提供支持或补充信息。这是我国监管部门首次在规范性文件中提到类器官技术,为未来类器官领域的监管归口提供了一定的线索。
本文将基于类器官技术的基本原理和应用,对类器官未来临床及商业化应用监管业态进行学术探讨,旨在为行业发展提供参考。
一、从细胞治疗监管口径变化看医药医疗领域监管逻辑
(一)细胞治疗行业监管口径变化历程与“双轨制”
国际上对细胞治疗产品和技术的监管方式总体分为两种,一种是作为产品,由药品监管部门进行临床准入审批;另一种则将其作为一种医疗技术,由卫生部门进行监管,医疗机构可依法决定临床应用。我国对细胞治疗的监管口径,经历了从“临床医疗技术”向“药品”的转变过程。
2009年, 原卫生部颁布《允许临床应用的第三类医疗技术目录》,其中包括自 体免疫细胞(T 细胞、NK 细胞)治疗技术;2015年,国务院取消第三类医疗技术临床应用准入的非行政许可审批;2016年,部分医疗事故的发生引发了全社会对细胞与基因治疗安全性的讨论,原卫计委暂停所有未经批准的第三类医疗技术的临床应用,明确要求所有免疫治疗技术仅可用于临床研究;2017年,原国家食药监局发布《细胞治疗产品研究与评价技术指导原则(试行)》等政策,开始明确细胞治疗按“药品”监管;2019年3月,国家卫生健康委发布《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿),业界一度热议细胞治疗将作为医疗技术进行管理,该办法征求意见后一直没有正式出台;2021年2月,国家卫生健康委对十三届全国人大三次会议第4371号建议的答复中,提到“干细胞、免疫细胞等细胞制剂具有明显的药品属性。国家药品监管部门已经为相关制剂通过药品审批制定配套政策,审批后可以迅速广泛应用,既有利于保障医疗质量安全,又有利于产业化、高质量发展”。当月,CDE正式发布《免疫细胞治疗产品临床试验技术指导原则(试行)》。2021年6月23日,国家药品监督管理局正式批准复星凯特生物科技有限公司CAR-T细胞治疗产品奕凯达(阿基仑赛注射液)新药上市申请,成为我国首个获批上市的细胞治疗类产品。
值得一提的是,2021年11月,浙江省卫健委在公布的答复省人大代表《关于在中国(浙江)自由贸易试验区内开展细胞技术研究和转化应用先行先试的建议》中明确,“国家卫生健康委科教司表示从国家监管层面,细胞治疗已逐渐转向按产品监管,由药品监管部门按药物审批后进入临床应用”,因此,“根据最近国家药监局批准CAR-T细胞治疗产品的情况,细胞治疗已不存在临床转化问题,而是应当作为药品,通过药监部门审批后进入临床应用”。在细胞治疗临床研究方面,原国家卫计委、国家食药监局颁布的《干细胞临床研究管理办法(试行)》明确,干细胞临床研究只能在三甲医疗机构进行,并在取得国家卫生健康委和国家药监局备案后开展,省级卫生健康和药监部门负责对干细胞临床研究备案项目进行初审。2020年国家卫生健康委下发通知,要求体细胞临床研究参照干细胞进行备案管理。
综上,在细胞治疗(含干细胞与体细胞)领域,目前仅在临床试验上存在“双轨制”;在临床应用治疗上,只存在通过国家药监局成药注册审批这一监管路径。
(二)我国对医药医疗的监管逻辑分析
基于上述基因细胞领域监管口径的演变过程,结合本轮“三医”改革的系列措施,我们认为,当前划分医药医疗监管口径的基本逻辑至少包含以下方面:
1. 以满足临床需求为核心,以降低医疗成本为导向,保障药械的有效性、安全性和可及性;
2. 在产业分工上,整体上由科研院所解决药械机理机制发现问题,由企业解决工艺生产和质控安全问题(CMC、QC等),由医疗机构提供医疗服务与临床场景应用;
3. 涉及复杂的CMC、QC环节的,倾向于按照“产品”监管;涉及临床医疗服务的,倾向于按照“医疗技术”监管。
二、从类器官技术的主要应用探析未来监管业态
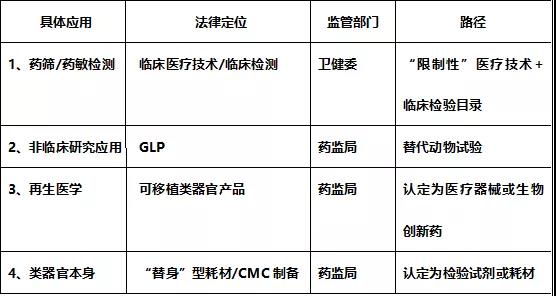
目前医学界普遍认为,类器官技术的应用主要包括临床治疗中的“试药替身”即药筛药敏检测、基础科研与新药研发服务(如新靶点发现、新药安全性评价),以及未来的再生医学三个方向。
(一)类器官药敏检测
在医疗实践中存在的肿瘤类器官个体化药敏检测,是用取自患者体内的原发性组织样本,在体外培养类器官组织作为“试药替身”,以从药物库中选择最合适病患的用药组合或诊疗方案。其本质上当属于《医疗技术临床应用管理办法》中规定的“以诊断和治疗疾病为目的,对疾病作出判断和消除疾病、帮助患者恢复健康而采取的医学专业手段和措施”,且属于《医疗机构临床实验室管理办法》中规定的“对提取自人体的各种标本进行细胞学等检验”的“临床检验工作”。
因此,我们认为,类器官在药敏检测方面的应用,当属于临床诊疗范畴内的临床检验服务(属暂未明确列入临床检验项目目录的临床检验项目),应由卫健委进行监管。
(二)基础科研与新药研发
以基因治疗产品为例,其新药研发阶段及主要内容如下:
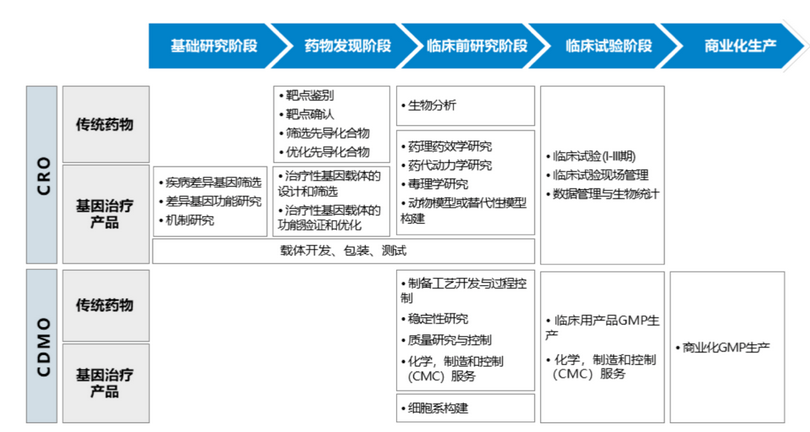
资料来源:和元生物招股说明书
从上述类器官的技术原理看,我们认为,类器官技术在POST-IND或IIT(研究者发起的临床)阶段应用空间不大。其在药物研发过程中的应用主要体现在基础研究、药物发现和临床前研究阶段,作为高度还原人体器官或组织的细胞组织,替代或补充相关动物实验进行非体内研究,评估相关药物的有效性和安全性。本次CDE也是在基因治疗、基因修饰细胞治疗的非临床研究阶段引入类器官技术作为验证手段。
综上,类器官技术在新药研发方面的应用应符合《药物非临床研究质量管理规范》等规定,由药监局监管。我们认为,后续有关类器官制备的技术标准或指南,或会由国家药监局作为监管与指导部门颁布。
(三)再生医学应用
再生医学被普遍认为是类器官技术的最终发展方向,其最终的产品形态为可植入医疗器械或特定药品,因此应由国家药监局按三类医疗器械或生物创新药管理。
(四)类器官培养本身
针对类器官培养,因其包含细胞提取、扩增、冷冻及复苏等技术环节,涉及复杂的CMC、QC过程,高度依赖于工艺技术人员的技能,同细胞和基因治疗产品的制备具有一定相似性。
我们认为,针对类器官培养,未来由药监局结合其在临床药敏检测、新药研发中作为“替身”的应用特征,以及复杂的CMC制备特征,按照“体外检测试剂或耗材”纳入监管的可能性较大。
综上所述,我们认为,从类器官基本原理和制备工艺特点看,其本身作为体外诊断试剂或耗材监管的可能性较大;从类器官技术的主要应用看,对其监管采用“双轨制”符合我国当前“三医”监管机制。也即,我们对未来类器官行业最终监管业态的分析具体如下表:
三、相关主体针对未来监管业务的应对建议
(一)医疗卫生机构的应对建议
1. 开展类器官技术的临床应用观察研究,履行临床技术入院程序
《医疗技术临床应用管理办法》明确规定,“临床应用安全性、有效性不确切”和“未经临床研究论证的医疗新技术”,禁止应用于临床。《医疗卫生机构开展临床研究项目管理办法》第2条明确,临床研究包括医疗卫生机构内开展的所有涉及人的药品和医疗器械(含体外诊断试剂)医学研究及新技术的临床应用观察等。
因此,拟开展类器官药敏检测服务的医疗机构,可及时开展相关临床应用观察研究,并按照临床医疗技术管理的规定,履行内部医疗技术临床应用技术论证和伦理审查。若所在省或直辖市卫健委在国家卫健委限制类医疗技术目录基础上,将类器官技术增补为限制类的,开展类器官药敏检测的医院应及时办理备案,并可积极承担该限制类临床医疗技术省内培训职责。
2. 当前积极布局LDT模式
2021年版《医疗器械监督管理条例》第53条规定,“对国内尚无同品种产品上市的体外诊断试剂,符合条件的医疗机构根据本单位的临床需要,可以自行研制,在执业医师指导下在本单位内使用。具体管理办法由国务院药品监督管理部门会同国务院卫生主管部门制定。”该条规定被普遍解读为监管部门对LDT模式正式认可。
我们认为,医疗机构可在按照医疗技术临床应用管理口径履行类器官技术入院程序的基础上,积极探索类器官药敏检测的LDT模式,具体需按照相关政策解读实施,如医疗机构分类、同种诊断产品界定(指至少2个相同临床预期用途和相同被测物的诊断产品)、临床执业医师执照要求、本单位自制自用要求等。
(二)类器官与CGT等相关企业的应对建议
1. 类器官企业可积极参与LDT入院模式
根据之前医疗实践,临床检验行业企业入院合作的模式主要包括以下三种:
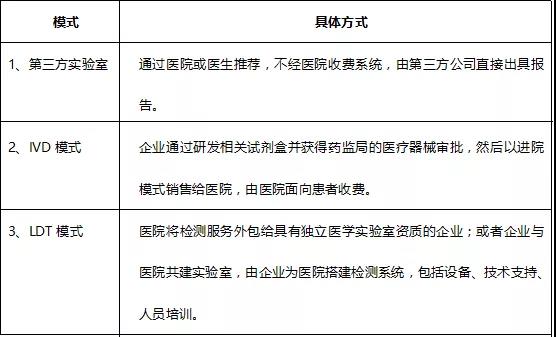
我们认为,在当前法律法规背景下,类器官企业开展药敏检测业务应首选LDT模式。
2. 在非临床研究领域积极布局产业合作
本次CDE文件提到的基因治疗领域,目前国内细胞与基因治疗企业以及相关CRO/CDMO企业的技术平台主要集中在载体开发技术和载体生产工艺及质控技术,且基本配备有动物实验技术平台,而多未搭建类器官技术平台。
因此,类器官企业和CGT企业,可按照GLP的要求,加强类器官技术平台服务合作。对于类器官企业而言,可不局限于CGT领域,积极扩大在全口径非临床研究领域的动物实验补充或替代占比。
3. 关注类器官领域“成药”的机会
特定的类器官组织(如部分填充组织)具备类似基因修饰细胞治疗产品的成药性,有望在药监局的药品注册监管通道下形成新的创新药产品。
本文作者:
声明:
本文由德恒律师事务所律师原创,仅代表作者本人观点,不得视为德恒律师事务所或其律师出具的正式法律意见或建议。如需转载或引用本文的任何内容,请注明出处。